Hoe chemische verbindingen te noemen
Schrijver:
Laura McKinney
Datum Van Creatie:
2 April 2021
Updatedatum:
26 Juni- 2024

Inhoud
- stadia
- Methode 1 Nomenclatuur van ionische verbindingen
- Methode 2 Nomenclatuur van polyatomaire verbindingen
- Methode 3 Nomenclatuur van Covalente verbindingen
Slagen op het gebied van chemie vereist weten hoe de chemische basisverbindingen moeten worden benoemd. Deze gids geeft u basisregels over het naamgevingsproces voor chemische verbindingen en over het toewijzen van namen aan verbindingen die u niet vertrouwd zijn.
stadia
Methode 1 Nomenclatuur van ionische verbindingen
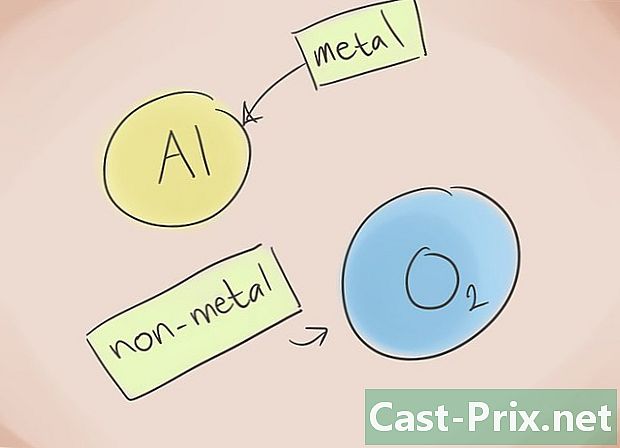
- Wat is een ionische verbinding? Ionische verbindingen bestaan uit een metaal en een niet-metaal. Raadpleeg vervolgens het Periodiek Systeem der Elementen om te weten welke categorieën bij de elementen horen die in de verbinding aanwezig zijn.
-

Vorm de naam. Niets is eenvoudiger dan een ionische verbinding van twee elementen te noemen. Het eerste deel van de naam van de verbinding komt inderdaad overeen met de naam van het niet-metalen element met het achtervoegsel "ure", terwijl het tweede deel overeenkomt met de naam van het metalen element. Er zijn uitzonderingen: oxide, fosfide, nitride, sulfide.- Voorbeeld: Al2O3. al2 = Aluminium; O3 = Zuurstof. Dus de naam van de verbinding zal "aluminiumoxide" zijn.
-
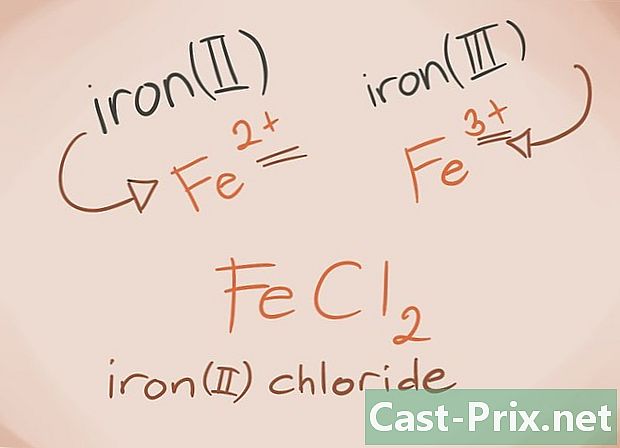
Ken de overgangsmetalen De overgangsmetalen zijn die gevonden in de D- en F-blokken van het periodiek systeem. In de naam van de verbinding is de lading op deze metalen geschreven in Romeinse cijfers. Dit komt omdat overgangsmetalen meer belasting kunnen dragen en meer een verbinding kunnen vormen.- Voorbeeld: FeCl2 en FeCl3. Fe = ijzer; cl2 = -2 Chloride; cl3 = Chloride -3. Als namen zal er ijzer (II) en ijzer (III) zijn.
Methode 2 Nomenclatuur van polyatomaire verbindingen
-

Je moet begrijpen wat een polyatomische verbinding is. Polyatomische verbindingen zijn verbindingen die worden gevormd door een groep van datomen die met elkaar zijn geassocieerd; de hele groep met een lading is positief of negatief. Er zijn dan drie basisacties die u kunt uitoefenen op polyatomaire verbindingen:- Je kunt een waterstof toevoegen aan het eerste deel van de verbinding. Het woord "waterstof" is inderdaad toegevoegd aan het begin van de naam van de verbinding. Dit verlaagt de waarde van de negatieve lading met één. Bijvoorbeeld het "carbonaat" CO3 wordt de "waterstofcarbonaat" HCO3.

- Je kunt ook zuurstof uit de verbinding verwijderen. De belasting wordt niet gewijzigd, maar het achtervoegsel "-ate" van de verbinding wordt gewijzigd in "-ique". Bijvoorbeeld de transformatie van: NO3 in NO2 we gaan van nitraat naar nitraat. "

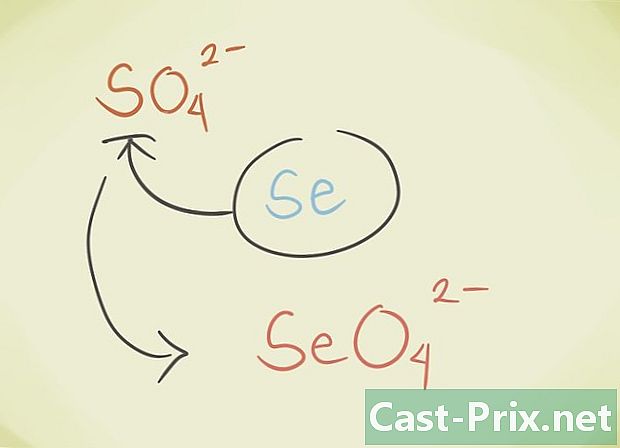
- Je kunt het centrale latoom van de verbinding vervangen door een ander atoom dat tot dezelfde periodieke groep behoort. Bijvoorbeeld SO-sulfaat4 kan worden vervangen door Selenate SeO4.
- Je kunt een waterstof toevoegen aan het eerste deel van de verbinding. Het woord "waterstof" is inderdaad toegevoegd aan het begin van de naam van de verbinding. Dit verlaagt de waarde van de negatieve lading met één. Bijvoorbeeld het "carbonaat" CO3 wordt de "waterstofcarbonaat" HCO3.
-

Onthoud de meest voorkomende dion-groepen. De onderstaande groepen worden gebruikt om de meeste polyatomische verbindingen te vormen. In navolging van de toenemende volgorde van hun negatieve lading hebben we:- hydroxide-ionen: OH
- nitraationen: NO3
- Waterstofcarbonaat-ionen: HCO3
- permanganaat-ionen: MnO4
- carbonaationen: CO3
- chromaationen: CrO4
- dichromaat-ionen: Cr2O7
- sulfaationen: SO4
- sulfietionen: SO3
- thiosulfaat-ionen: S2O3
- Fosfaationen: PO4
- ammoniumionen: NH4
- Vorm samengestelde namen uit de bovenstaande lijst. Vorm een naamkoppeling met een van de items die aan de groep zijn gerelateerd. Als het element vóór de ionische groep wordt geplaatst, wordt de elementnaam eenvoudig toegevoegd aan het begin van de samengestelde naam.
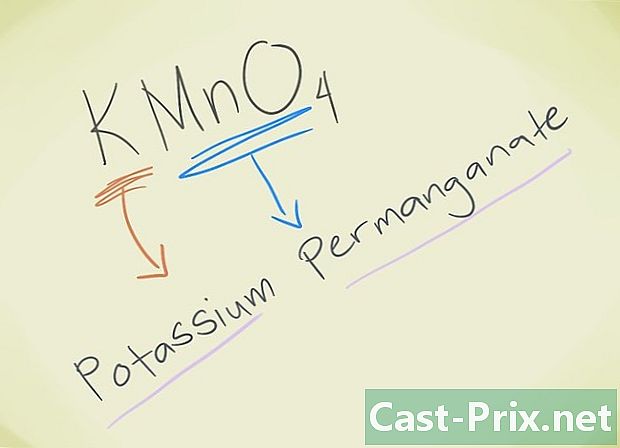
- Voorbeeld: KMnO4. Je moet die leeuw MnO kunnen kennen4 komt overeen met leeuwpermanganaat. K verwijst naar kalium. Dus je verbinding zal Permanganate Kalium worden genoemd.
- Voorbeeld: NaOH. Je zult hier waarschijnlijk begrepen hebben dat het OHOH is. Na is natrium, dus de verbinding wordt natriumhydroxide genoemd.

- Voorbeeld: KMnO4. Je moet die leeuw MnO kunnen kennen4 komt overeen met leeuwpermanganaat. K verwijst naar kalium. Dus je verbinding zal Permanganate Kalium worden genoemd.
Methode 3 Nomenclatuur van Covalente verbindingen
-
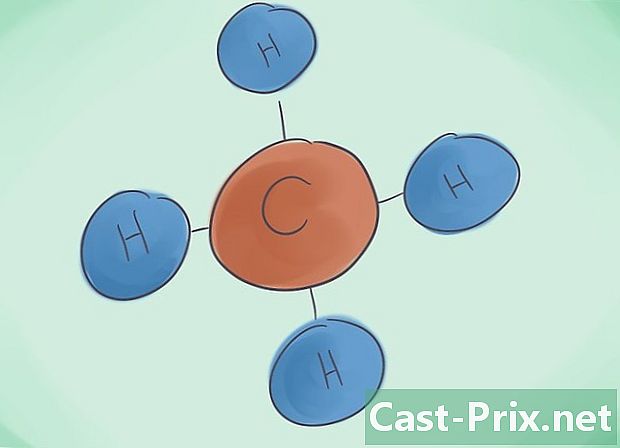
Wat is een covalente verbinding? De covalente verbindingen zijn het gevolg van de associatie van ten minste twee niet-metalen elementen. De naam van de verbinding wordt bepaald door het aantal datomen waaruit deze bestaat. Het Griekse voorvoegsel naast deze naam geeft het aantal aanwezige moleculen in de verbinding aan. -
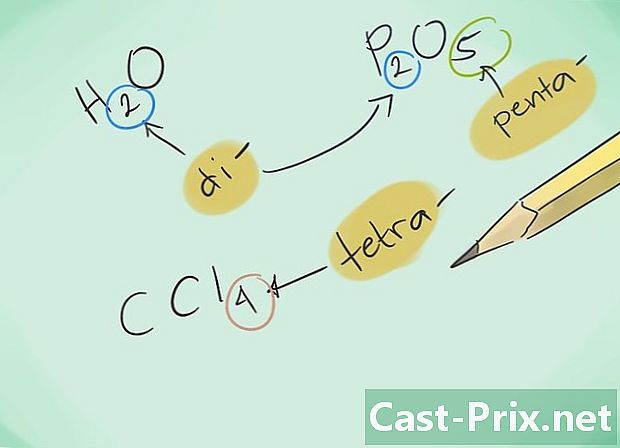
Maak uzelf vertrouwd met de voorvoegsels. Onthoud de volgende voorvoegsels voor verbindingen met 1 tot 8 atomen:- 1 atoom - "Mono-"
- 2 atomen - "Di-"
- 3 atomen - "Tri-"
- 4 atomen - "Tetra-"
- 5 atomen - "Penta-"
- 6 atomen - "Hexa-"
- 7 atomen - "Hepta-"
- 8 atomen - "Octa-"
- Geef vervolgens de verbindingen een naam. Geef de resulterende verbinding een naam met de juiste voorvoegsels. De voorvoegsels moeten worden geënt op elk van de elementen die een verbinding met meerdere atomen vormen.
- Voorbeeld: CO keert terug naar koolmonoxide terwijl CO2 zal koolstofdioxide aanduiden.
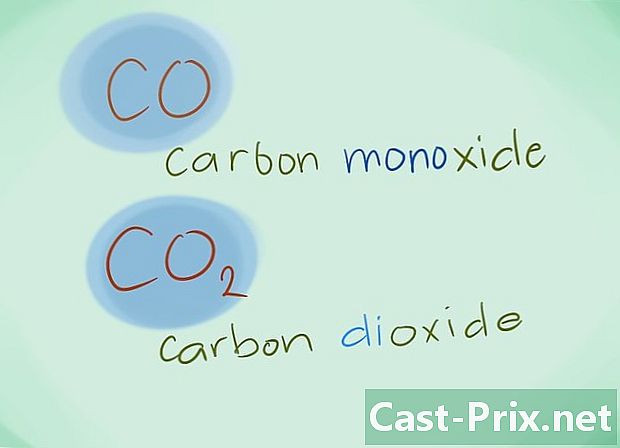
- Voorbeeld: N2S3 zou overeenkomen met nitreuze trisulfide.

- In de meeste gevallen kan het voorvoegsel "mono" worden weggelaten; dit leidt, meer dan enig gebrek aan voorvoegsel, ertoe dat het laatste moet worden gebruikt. Dit voorvoegsel wordt nog steeds gebruikt in het geval van koolmonoxide, gezien het feit dat dit gebruik teruggaat tot de eerste glimpen van de chemie.
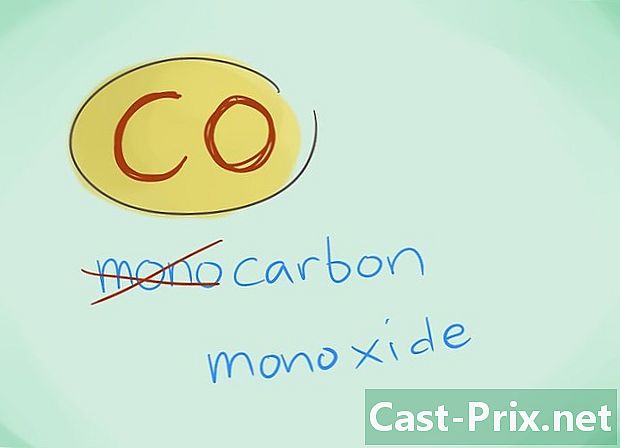
- Voorbeeld: CO keert terug naar koolmonoxide terwijl CO2 zal koolstofdioxide aanduiden.
- Natuurlijk vermoed je dat op al deze regels verschillende uitzonderingen van toepassing zijn; houd bijvoorbeeld deze formule, CaCl2Je verwacht dat het "calciumdichloride" wordt genoemd, wat GEEN is. Uw verbinding zal eenvoudig de naam calciumchloride behouden.
- Er moet ook worden opgemerkt dat dit alles niet van toepassing is op organische chemie.
- De gedetailleerde regels hier zijn bedoeld voor een beginnend publiek in chemie en wetenschap. Er zijn heel verschillende regels als je door de geavanceerde chemiefase gaat, zoals de regels voor variabele valentie.

